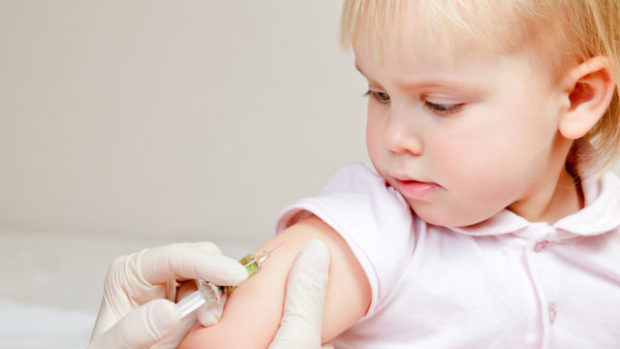
Регулирующие органы США призывают производителя лекарств Pfizer подать заявку на экстренное разрешение на применение двухдозового режима вакцины против Covid-19 в отношении детей в возрасте от шести месяцев до 5 лет.
Ранние данные Pfizer показали, что вакцина, которую вводят младшим детям в дозе, составляющей одну десятую дозы взрослой вакцины, безопасна и вызывает иммунный ответ.
Но в прошлом году Pfizer объявила, что вакцина с двумя дозами оказалась менее эффективной для предотвращения Covid-19 у детей в возрасте от 2 до 5 лет.
Поэтому регулирующие органы призвали компанию добавить третью дозу в исследование, полагая, что еще один укол, очень похожий на бустерный для взрослых, повысит эффективность вакцины.
Управление по санитарному надзору за качеством пищевых продуктов и медикаментов подталкивает компанию к подаче заявки на потенциальное одобрение на основе данных о двух дозах в феврале, а затем вернуться за дополнительным разрешением после получения результатов исследования третьей дозы, которое ожидается в марте.
Двухэтапный процесс авторизации может означать, что самые маленькие дети могут быть вакцинированы более чем на месяц раньше, чем предполагалось ранее, при условии, что FDA и Центр по контролю и профилактике заболеваний дадут зеленый свет на прививки.
Первичная двудозовая серия прививок вакциной Pfizer проводится с интервалом в три недели. Третья доза для маленьких детей изучается для приема по крайней мере через два месяца после второй дозы.